甘肅2021年成考高起點《化學》考前重點知識回顧
分子、原子、離子、元素、化合價的相關觀點:
1、分子是保持物質化學性質的一種粒子
2、分子是原子構成的考試用書
3、分子、原子的體積和質量都很小
4、分子、原子都不斷運動
5、分子、原子間有一定間隔,可以壓縮
6、同種物質的分子化學性質相同
7、在物理變化中,分子本身不變,只是間隔改變
8、在化學變化中,分子組成和種類都改變
9、分子和原子的本質區別是在化學變中是否可以再分
10、離子是帶電的原子或原子團
11、原子中:質子數=核電荷數=核外電子數=原子序數
12、原子在化學變化中有“三不變”原子種類不變、原子數目不變、質量不變
13、稀有氣體原子和離子的最外層電子數都達到穩定結構,但達到穩定結不一定是稀有氣體原子
14、核電荷數或質子數相同的一類原子屬于同種元素
15、同種元素的核電荷數或質子數相同
16、不同種元素的本質區別是質子數或核電荷數不同
17、元素的化學性質與其原子結構的最外層電子數有密切關系
18、地殼中元素的含量為:O Si Al Fe Ca Na K Mg H…人體中前四位的元素的含量:O C H N
元素活動性順序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
19、原子的相對原子質量=質子數+中子數
20、單質中元素化合價為零;化合物中元素正負化合價代數和為零
21、元素只講種類不講個數
22、原子是化學變化中的最小粒子,不能再分
23、有單質參加或有單質生成的變化,化合價一定會改變
24、元素周期表中,原子序數=質子數
物質變化、物質性質、物質分類:
1、物理變化是沒有新物質生成的變化,一般指形狀改變或三態轉變
2、化學變化是有新物質生成的變化
3、物理變化和化學變化的本質區別是是否有新物質生成(判斷依據)
4、微觀上化學變化的實質是分子分成原子,原子重新組合,得到新分子,生成新物質
5、氧化物要滿足兩個條件:①兩種元素②其中一種是氧元素
6、燃燒的三個條件是:①可燃物②有空氣或氧氣③溫度達到著火點
7、可燃性氣體+助燃性氣體+點燃……可能會發生爆炸
8、提高燃燒效率的兩種方法:
①有充足的空氣②增大可燃物和空氣的接觸面積
9、燃燒、緩慢氧化、自燃的共同點有:
①都和氧氣反應②都放出熱量③都是氧化反應
10、特別的物理變化有:石油的分餾,干冰升華,礦石粉碎,潮解
11、特別的化學變化有:煤的干餾,物質變質,風化
12、特別的混合物:
溶液,合金,礦石,空氣,煤、石油、天然氣、水煤氣都是混合物
13、六大營養物質:
糖類、蛋白質、油脂、維生素、無機鹽、水。其中前四位是有機物
14、三大合成材料:合成橡膠、合成纖維、塑料
質量守恒定律
1、參加化學反應的各物質質量總和等于生成的各物質質量總和
2、化學反應中“三個不變”原子(元素)種類不變,原子數目不變,質量不變
“一個一定變”分子種類(分子組成)一定變
“一個不一定變”分子數目不一定變
元素的一些特殊性質
1.周期表中特殊位置的元素
①族序數等于周期數的元素:H、Be、Al、Ge。②族序數等于周期數2倍的元素:C、S。
③族序數等于周期數3倍的元素:O。④周期數是族序數2倍的元素:Li、Ca。
⑤周期數是族序數3倍的元素:Na、Ba。⑥最高正價與最低負價代數和為零的短周期元素:C。
⑦最高正價是最低負價絕對值3倍的短周期元素:S。⑧除H外,原子半徑最小的元素:F。
⑨短周期中離子半徑最大的元素:P。
2.常見元素及其化合物的特性
①形成化合物種類最多的元素、單質是自然界中硬度最大的物質的元素或氣態氫化物中氫的質量分數最大的元素:C。②空氣中含量最多的元素或氣態氫化物的水溶液呈堿性的元素:N。③地殼中含量最多的元素、氣態氫化物沸點最高的元素或氫化物在通常情況下呈液態的元素:O。④最輕的單質的元素:H;最輕的金屬單質的元素:Li。⑤單質在常溫下呈液態的非金屬元素:Br;金屬元素:Hg。⑥最高價氧化物及其對應水化物既能與強酸反應,又能與強堿反應的元素:Be、Al、Zn。⑦元素的氣態氫化物和它的最高價氧化物對應水化物能起化合反應的元素:N;能起氧化還原反應的元素:S。⑧元素的氣態氫化物能和它的氧化物在常溫下反應生成該元素單質的元素:S。⑨元素的單質在常溫下能與水反應放出氣體的短周期元素:Li、Na、F。⑩常見的能形成同素異形體的元素:C、P、O、S。
元素化合物
1、氧氣具有氧化性,常見的氧化劑
2、碳在氧氣燃燒放出白光,產物能使石灰水變渾濁(二氧化碳CO2)
3、硫在空氣燃燒產生淡藍色火焰,在純氧氣中產生明亮藍紫色火焰,產物都有刺激性氣味
4、磷在氧氣中產生大量的白煙
5、鎂燃燒產生耀眼的白光,產物為白色的固體
6、鋁在氧氣燃燒產生白光,產物為白色固體,不能在空氣中燃燒
7、鐵在氧氣燃燒火星四射,放出大量的熱,產物為黑色固體。瓶底要放點水或鋪些砂,鐵絲要縛在一條小木條上
8、銅在空氣中加熱由紅色變黑色
9、氫氣,一氧化碳,甲烷燃燒都產生藍色的火焰,鑒別應看產物
10、鑒別硬水和軟水的方法是加入肥皂水或加熱
11、水凈化的方法有:沉淀,過濾,吸附,蒸餾
12、二氧化碳通入紫色石蕊試液,試液變紅色
13、二氧化碳能使石灰水變渾濁
化學用語:
1、元素符號表示意義有:
①表示某種元素
②表示該元素的一個原子
③有些還可以表示單質的化學式(金屬和稀有氣體)
2、化學式表示的意義有:
①表示某物質
②表示該物質的一個分子(想一想哪些不符合)
③表示該物質由何種元素組成
④表示一個某某分子由幾個某某原子構成
3、離子符號表示某離子
4、化學方程式可知:
①該化學反應的反應物和生成物,以及反應條件
②各物質間的質量比
③參加反應的粒子數(計量數)
5、活用:
①元素符號前的數字表示原子的個數
②元素符號右下角的數字表示一個某分子由幾個某原子構成(即原子的個數比)
③元素符號右上角的數字表示一個某離子帶幾個單位的正(或負)電荷
④元素符號正上方的數字表示該元素的化合價
6、化學式前的數字表示分子的個數
7、離子符號前的數字表示離子的個數
8、化學方程式的書寫原則:
①以客觀事實為基礎
②遵守質量守恒定律
“10電子”、“18電子”的微粒小結
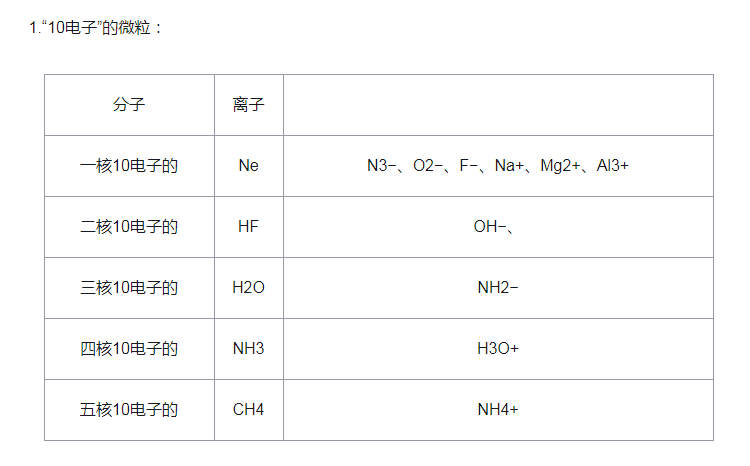
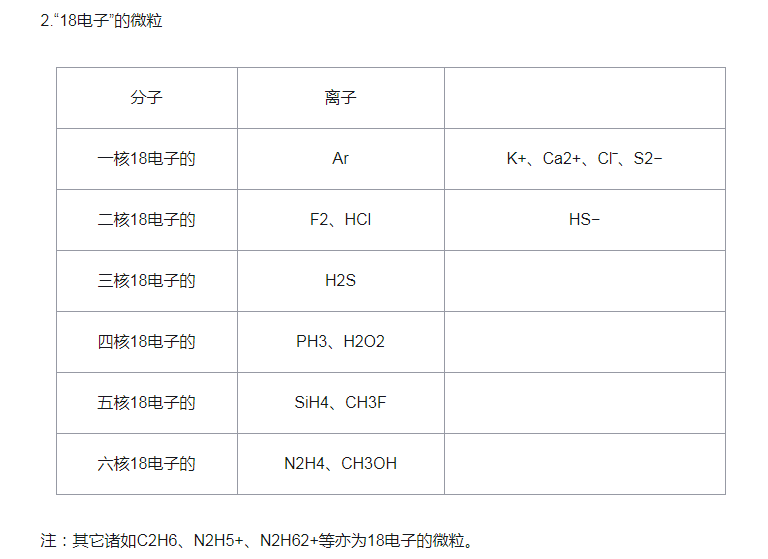
微粒半徑的比較:
1.判斷的依據 電子層數: 相同條件下,電子層越多,半徑越大。
核電荷數: 相同條件下,核電荷數越多,半徑越小。
最外層電子數 相同條件下,最外層電子數越多,半徑越大。
1.具體規律:1、同周期元素的原子半徑隨核電荷數的增大而減小(稀有氣體除外)
如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半徑隨核電荷數的增大而增大。如:Li
3、同主族元素的離子半徑隨核電荷數的增大而增大。如:F--
4、電子層結構相同的離子半徑隨核電荷數的增大而減小。如:F-> Na+>Mg2+>Al3+
5、同一元素不同價態的微粒半徑,價態越高離子半徑越小。如Fe>Fe2+>Fe3+
滴加順序不同,現象不同
1.AgNO3與NH3·H2O:
AgNO3向NH3·H2O中滴加——開始無白色沉淀,后產生白色沉淀
NH3·H2O向AgNO3中滴加——開始有白色沉淀,后白色沉淀消失
2.NaOH與AlCl3:
NaOH向AlCl3中滴加——開始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加——開始無白色沉淀,后產生白色沉淀
3.HCl與NaAlO2:
HCl向NaAlO2中滴加——開始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加——開始無白色沉淀,后產生白色沉淀
4.Na2CO3與鹽酸:
Na2CO3向鹽酸中滴加——開始有氣泡,后不產生氣泡
鹽酸向Na2CO3中滴加——開始無氣泡,后產生氣泡
能使酸性高錳酸鉀溶液褪色的物質
(一)有機
1.不飽和烴(烯烴、炔烴、二烯烴、苯乙烯等);
2.苯的同系物;
3.不飽和烴的衍生物(烯醇、烯醛、烯酸、鹵代烴、油酸、油酸鹽、油酸酯等);
4.含醛基的有機物(醛、甲酸、甲酸鹽、甲酸某酯等);
5.石油產品(裂解氣、裂化氣、裂化汽油等);
6.煤產品(煤焦油);
7.天然橡膠(聚異戊二烯)。
(二)無機
1.-2價硫的化合物(H2S、氫硫酸、硫化物);
2.+4價硫的化合物(SO2、H2SO3及亞硫酸鹽);
3.雙氧水(H2O2,其中氧為-1價)
9、最簡式相同的有機物
1.CH:C2H2和C6H6
2.CH2:烯烴和環烷烴
3.CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖
4.CnH2nO:飽和一元醛(或飽和一元酮)與二倍于其碳原子數和飽和一元羧酸或酯;舉一例:乙醛(C2H4O)與丁酸及其異構體(C4H8O2)
10、同分異構體(幾種化合物具有相同的分子式,但具有不同的結構式)
1、醇—醚CnH2n+2Ox 2、醛—酮—環氧烷(環醚)CnH2nO
3、羧酸—酯—羥基醛CnH2nO2 4、氨基酸—硝基烷
5、單烯烴—環烷烴CnH2n 6、二烯烴—炔烴CnH2n-2
11、能發生取代反應的物質及反應條件
1.烷烴與鹵素單質:鹵素蒸汽、光照;
2.苯及苯的同系物與①鹵素單質:Fe作催化劑;
②濃硝酸:50~60℃水浴;濃硫酸作催化劑
③濃硫酸:70~80℃水浴;
3.鹵代烴水解:NaOH的水溶液;
4.醇與氫鹵酸的反應:新制的氫鹵酸(酸性條件);
5.酯類的水解:無機酸或堿催化;
6.酚與濃溴水(乙醇與濃硫酸在140℃時的脫水反應,事實上也是取代反應。)
元素的一些特殊性質
1.周期表中特殊位置的元素
①族序數等于周期數的元素:H、Be、Al、Ge。②族序數等于周期數2倍的元素:C、S。
③族序數等于周期數3倍的元素:O。④周期數是族序數2倍的元素:Li、Ca。
⑤周期數是族序數3倍的元素:Na、Ba。⑥最高正價與最低負價代數和為零的短周期元素:C。
⑦最高正價是最低負價絕對值3倍的短周期元素:S。⑧除H外,原子半徑最小的元素:F。
⑨短周期中離子半徑最大的元素:P。
2.常見元素及其化合物的特性
①形成化合物種類最多的元素、單質是自然界中硬度最大的物質的元素或氣態氫化物中氫的質量分數最大的元素:C。②空氣中含量最多的元素或氣態氫化物的水溶液呈堿性的元素:N。③地殼中含量最多的元素、氣態氫化物沸點最高的元素或氫化物在通常情況下呈液態的元素:O。④最輕的單質的元素:H;最輕的金屬單質的元素:Li。⑤單質在常溫下呈液態的非金屬元素:Br;金屬元素:Hg。⑥最高價氧化物及其對應水化物既能與強酸反應,又能與強堿反應的元素:Be、Al、Zn。⑦元素的氣態氫化物和它的最高價氧化物對應水化物能起化合反應的元素:N;能起氧化還原反應的元素:S。⑧元素的氣態氫化物能和它的氧化物在常溫下反應生成該元素單質的元素:S。⑨元素的單質在常溫下能與水反應放出氣體的短周期元素:Li、Na、F。⑩常見的能形成同素異形體的元素:C、P、O、S。
版權聲明:本文“甘肅2021年成考高起點《化學》考前重點知識回顧”來自“甘肅成人高考網”,內容來自互聯網,有關成人高考高起專、高起本、專升本的報名時間、入口、費用等信息內容請以甘肅省教育考試院官網為準。若轉載,請注明:http://www.zhaomingming.cn/gqb/1814.html,若本站收錄的信息無意侵犯了版權等相關問題,請給我們致電或留言,我們會第一時間處理和回復。










文章評論(已有條評論)